بنزوئیک اسید با فرمول مولکولی ترکیبی بلوری بی رنگ که به رنگ سفید دیده می شود . ساده ترین کربوکسیلیک اسید آروماتیک می باشد . ( به دلیل دارا بودن حلقه بنزنی آروماتیک ) قدرت اسیدی ضعیفی دارد و از نمک های آن مثل سدیم بنزوات به عنوان نگهدارنده های مواد غذایی استفاده می شود . این ترکیب به عنوان ماده اولیه برای ساخت سایرترکیب های آلی دیگر می باشد .
بنزوئیک اسید به طور طبیعی در بسیاری از گیاهان ( تمشک ) وجود دارد . این اسید در دمای 122 درجه سلسیوس ذوب شده و در دمای 250 درجه سلسیوس می جوشد . میزان انحلال پذیری آن در آب ، 3.4 گرم بر لیتر است و در حلال های آلی مثل متانول ، اتانول و آمونیاک مایع حل می شود . این اسید ، از اکسایش نسبی متیل بنزن ( تولوئن ) با اکسیژن و حتی بنزالدهید به صورت تجاری تولید می شود .
سطح معمول استفاده از بنزوئیک اسید به عنوان ماده نگهدارنده در غذا بین 0.05 تا 0.1 درصد است . بنزوئیک اسید و نمک های آن ، در برخی نوشابه ها با اسکوربیک اسید ( ویتامین C موجود ) واکنش نشان داده و احتمال سرطان زا بودن آن را افزایش می دهد .
از بنزوئیک اسید در تولید فِنُل می توان استفاده کرد، به طوری که در دمای 300 تا 400 درجه سلسیوس گروه کربوکسیل به گروه هیدروکسیل تبدیل می شود ( البته در این واکنش از نمک های مس (II) به عنوان کاتالیزگر استفاده می شود . و از طرفی فِنُل می تواند به سیکلوهگزانول تبدیل شود که از این ماده برای سنتز نایلون استفاده می شود . بنزوئیک اسید در تولید پمادهای ضد عفونت قارچی پوست کاربرد دارد .
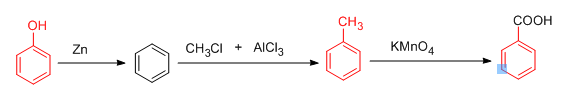
از جمله واکنش های مهم بنزوئیک اسید می توان به طرز تهیه و یا استفاده از آن به عنوان ماده اولیه مثال زد .
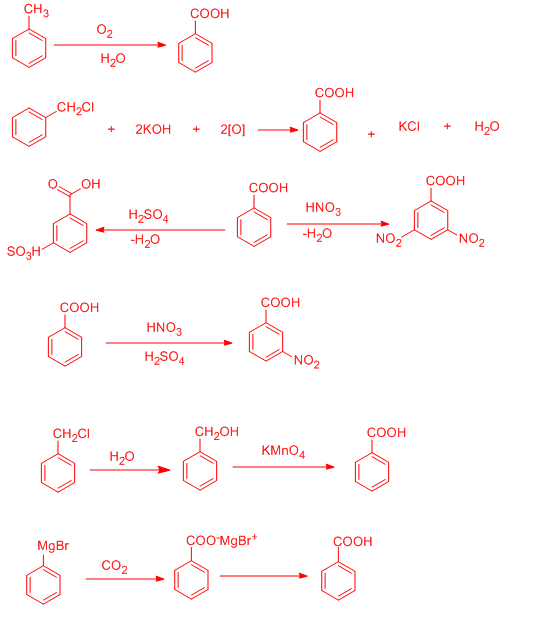
واکنش تهیه بنزوئیک اسید از تولوئن :
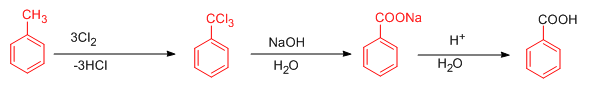
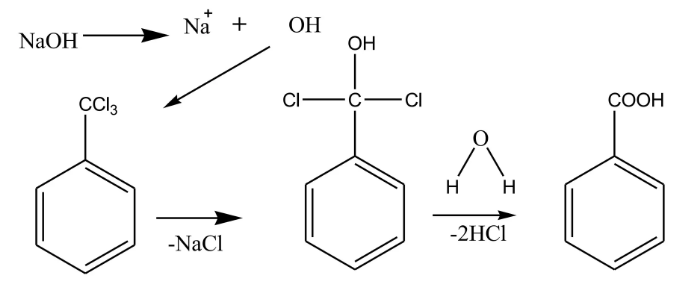
مکانیسم واکنش تبدیل تولوئن به بنزوئیک اسید :
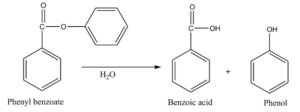
تهیه بنزوئیک اسید از هیدرولیز فنیل بنزوات :
تبدیل فنُل به بنزوئیک اسید با استفاده از آلکیلاسیون فریدل-کرافت :
در این ماده ، گروه بنزوئیل اغلب به صورت “BZ” خوانده می شود که نباید آن را با “Bn” که نشانگر بنزیل است اشتباه بگیریم . پس بنزوئیک اسید به صورت
BzOH نیز نشان داده می شود . می دانیم که گروه بنزوئیل دارای فرمول است .
می توان گفت کهاین اسید ، ساده ترین اسید آروماتیک معطر می باشد و این نام از صمغ بنزوئین گرفته شده است ، که سال ها تنها منبع تولید آن بود . از طرفی بنزوئیک اسید به را می توان به عنوان یک واسطه در سنتز بسیاری از ترکیبات آلی استفاده کرد .
این ماده بیشترین کاربرد را برای تولید عطر ، رنگ ، داروهای موضعی و داروی دفع حشرات دارد . سدیم بنزوات را می توان به عنوان تنظیم کننده میزان اسیدیته مواد غذایی و نگهدارنده نیز استفاده کرد . این ماده همچنین می تواند مانع رشد میکروب ها در جهت حفظ سلامت غذا شود .
این اسید مانع ایجاد عفونت توسط باکتری ها شود و سالیسیلیک اسید که یکی از مشتقات این ماده است می تواند سلول های مُرده را از بین ببرد . بنزوئیک اسید و سالیسیلیک اسید در ساختار دارویی کاربرد دارد که برای درمان تحریک و التهاب پوست در اثر سوختگی ، نیش حشرات و عفونت های قارچی یا اگزما استفاده می شود .




